
Last Updated on Şubat 19, 2026 by EDİTÖR
Nöroanatomik izleme deneyleri için kullanılan hayvanların çoğu, 2 aylık C57BL/6J erkek farelerdi (N= 95; Jackson Laboratuvarları). Fareler sıcaklık kontrollü (21–22 °C), nem kontrollü (%51) ve ışık kontrollü (12 saat – 12 saat aydınlık-karanlık döngüsü; ışıklar açık, 06:00; ışıklar kapalı, 18:00) bir odada barındırıldı. Yiyecek ve su istenildiği kadar verildi. Tesise vardıktan sonra farelerin, ameliyatlar gerçekleştirilmeden önce barınma ortamına uyum sağlamaları için en az 1 hafta süre tanındı. Deneylerin tümü, Ulusal Sağlık Enstitüleri Laboratuvar Hayvanlarının Bakımı ve Kullanımı Rehberi tarafından belirlenen standartlara ve Güney Kaliforniya Üniversitesi (USC) ve Kaliforniya Los Angeles Üniversitesi’nin (UCLA) kurumsal kurallarına uygun olarak gerçekleştirildi.
Erkek MORF3 fareleri (N= 20; 2 aylık) nöroanatomik sistem takibi için de kullanıldı. XW Yang’ın UCLA’daki laboratuvarı tarafından oluşturulan MORF3 fare çizgisi (C57BL/6-Gt(ROSA)26Sortm3(CAG-sfGFP*)Xwy/J)25in vivo hücre etiketlemesi için bir çeviri anahtarı olarak bir mononükleotid tekrar çerçeve kaydırmasını (MORF) kullanan bir Cre raportör fare çizgisidir. MORF3 fareleri, bir CAG promotörünün kontrolü altında bir polisitoz tekrarı (C22) MORF anahtarının ardından 20 V5 epitopuna (smFP-V5) sahip Cre’ye bağımlı bir tandem ‘spagetti canavarı’ floresan proteini eksprese eder. Cre rekombinasyonu, spontan çerçeve değişimiyle birleştiğinde, sinir hücrelerinin seyrek ve stokastik etiketlenmesine neden olur.
VGLUT2 Cre (B6J.129S6(FVB)-Slc17a6tm2(cre)Lowl/MwarJ) ve CRH-Cre (B6(Cg)-Crhtm1(cre)Zjh/J) dahil olmak üzere diğer iki transgenik fare çizgisi JAX’tan satın alındı ve bu fare çizgileri için üreme kolonileri UCLA’da kuruldu. CRH-Cre fareleri, bazı deneyler için CRH-Cre Ai14 fareleri oluşturmak üzere Ai14 fareleriyle çaprazlandı. Nöroanatomik izleme deneyleri için toplam 5 erkek VGLUT2 Cre, 5 CRH-Cre ve 2 aylık 4 CRH-Cre Ai14 faresi kullanıldı. İzleme dışı çalışmalara yönelik hayvan bilgileri, aşağıdaki ilgili alt bölümlerde yer almaktadır.
İzleme ve morfoloji deneylerinin her biri için örnek boyutları önceki deneyimlere göre seçildi. Hayvanlar farklı gruplara atanmadığından sinir izleme deneyleri için randomizasyon yapılmadı. Önyargıyı azaltmak ve değişkenliği kontrol etmek için rastgeleleştirme gereklidir. Bunun yerine veriler farklı yöntemlerle doğrulandı (‘Verilerin tekrarlanabilirliği’ bölümüne bakın). Morfoloji deneyleri için rastgeleleştirme de gerekli değildi. MORF3’ün özellikleri sayesinde nöronların rastgele etiketlenmesini sağlıyoruz ve ardından izlenebilir nöronları yeniden yapılandırıyoruz. Nöroanatomik izleme ve morfoloji deneyleri için, hayvanlar farklı gruplara atanmadığından körleme de gerekli değildi.
Etik araştırma uygulamalarını teşvik etmeye ve çalışmalarımıza katılan tüm hayvanların refahını sağlamaya kararlıyız. Tüm prosedürler, Ulusal Sağlık Enstitüleri Laboratuvar Hayvanlarının Bakımı ve Kullanımı Kılavuzu’nda belirtilen düzenleyici standartlara ve ayrıca Güney Kaliforniya Üniversitesi (USC) ve Kaliforniya Üniversitesi, Los Angeles (UCLA) Kurumsal Hayvan Bakım ve Kullanım Komiteleri tarafından belirlenen kurumsal yönergelere uyuldu.
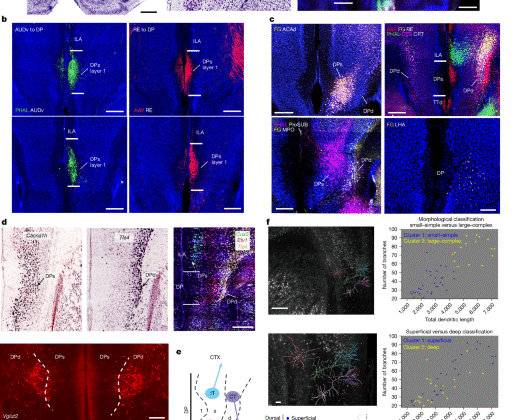
Phaseolus vulgaris leucoaglutinin (PHAL; %2,5; Vector Laboratories) ana kimyasal ileriye dönük izleyici olarak kullanıldı. Kimyasal retrograd izleyiciler arasında kolera toksini alt birimi b (CTB Alexa Fluor 647 konjugatı, %0,25; Invitrogen) ve FG (%1; Florokrom) yer alıyordu. FG ayrıca nöroendokrin hücrelerini etiketlemek için kuyruk damarından (%2, 30 ul) enjekte edildi. Her bir anterograd ve retrograd izleyicinin farklı özellikleri vardır ve bağlantı sonuçlarını anlamlı şekilde etkileyebilecek çeşitli nörotropizm sergiler. Örneğin, anterograd AAV’ler geçiş liflerini etiketlerken PHAL bunu yapmaz. Bu farklılıklar veri doğrulamanın önemini vurgulamaktadır. Bu çalışmada, sonuçların güvenilirliğini sağlamak için bağlantı verileri birçok yolla doğrulandı. Retrograd izleyiciler, anterograd sonlandırma bölgelerine yerleştirilirken, anterograd izleyiciler, retrograd olarak etiketlenmiş hücrelerin bölgelerine yerleştirildi. Örneğin, Genişletilmiş Veri Şek. 10 DP’lerde ve DPd’de, beyin çapındaki farklı girdilerini (DP’lere veya DPd’ye beyin çapında ROI’ler) ortaya çıkaran retrograd izleyici enjeksiyonunu gösterir. Bu sonuçları doğrulamak için Genişletilmiş Veri Şek. 11 DP’lere veya DPd’ye projeksiyonlarını doğrulamak için beyin çapındaki ROI’lere iletilen anterograd izleyici enjeksiyonlarını gösterir. Ayrıca, daha önce PHAL ve AAV’nin benzer beyin çapında ileriye dönük etiketleme modelleri ürettiğini göstermiştik.21 (Ek Şek. 6).
AAVretro-hSyn-Cre-WPRE (AAV retro Cre; 1,6 × 1013 ml başına genom kopyaları (GC); Addgene, 105553), AAV1-Syn-Flex-GCaMP6f-WPRE-SV40, AAV1-hSyn-SIO-stGtACR2-FusionRed ve AAV-Ef1a-mCherry-IRES-Cre (retrograd)53 Addgene tarafından üretildi.
Geliştirilmiş yeşil floresan proteini (AAV-GFP; AAV2/1.hSynapsin.EGFP.WPRE.bGH) ve tdTomato (AAV1.CAG.tdtomato.WPRE.SV40) ve AAV1-hSyn-Cre-WPRE-hGh (anterograd trans-sinaptik) kodlayan viral anterograd izleyiciler AAV, UPenn Vector Core tarafından paketlendi. AAV5-Ef1a-DIO-hChR2(H134R)-eYFP, AAV9-CAG-FLEX-GFP (AAV’yi ifade eden Cre’ye bağımlı kanalrhodopsin), Kuzey Carolina Üniversitesi vektör çekirdek tesisi tarafından üretildi.
DP akson terminallerinin PVH CRH nöronları üzerindeki sinaptik temaslarını araştıran deneyler için, CRH-Cre Ai14 erkek farelerin DP’sine bir AAV-sinaptofizin-GFP enjeksiyonu yapıldı (N= 4, 2 aylık). 1:1 AAV Cre ve AAV sinaptofizin-GFP karışımı oluşturuldu ve istenen ROI’ye 100 nl basınç enjeksiyonu yapıldı. Karışım için kullanılan virüsler AAV1-hSyn-FLEX-tdTomato-T2A-SypGFP-WPRE (Addgene, 51509, 1.3 x 106) idi.13 GC/ml) ve AAV1-hSyn-Cre-WPRE (Addgene, 105553, 1,8 × 106)13 GC/ml).
Genetiği değiştirilmiş kuduz izleme sistemi için kullanılan viral vektörler, MIT’deki Wickersham Laboratuvarı tarafından üretildi ve AAV2/9-CAG-FlexmKate-T2A-TVA, AAV2/9-CAG-Flex-mKate-T2A-N2c-G ve Rbv-CVS-N2c-ΔG-GFP’yi (modifiye edilmiş kuduz virüsü) içeriyordu. Tüm viral vektörler bölüntülendi ve kullanılıncaya kadar 80 °C’de saklandı. Daha da önemlisi, kuduz virüsü, presinaptik girdileri belirli bir beyin bölgesine veya başlangıç hücre popülasyonuna güvenilir bir şekilde haritalamak için bir araç olarak yaygın şekilde kullanılmaktadır.54,55,56. Trotizmi geniş görünse de, farklı yollardaki belirli hücre tiplerinin diğer retrograd izleyicilerin ve virüslerin (örneğin, AAVretro, CAV2, retrobeads vb.) performansına göre fazla veya az temsil edilmesi mümkün olmaya devam etmektedir.57,58. Ayrıca, başlatıcı hücre popülasyonu içindeki sitotoksisite potansiyeli, kuduzun, başlatıcı hücrelerle spesifik olarak temas eden sinapslar yerine yakındaki sinapslara spesifik olmayan bir şekilde yayılması için bir fırsat sağlayabilir. Bu olasılıkları kontrol etmek için, retrograd izleme sonuçlarının, yukarı akış bölgesinden aksonal bağlantıların izlenmesi veya yukarı akış aksonlarının optogenetik olarak uyarılması ve hedef hücre popülasyonunda sinaptik yanıtların kaydedilmesi gibi tamamlayıcı anterograd yaklaşımlar kullanılarak doğrulanması gerekir. Bu nedenle sunduğumuz veriler birkaç farklı yolla doğrulandı.
Nöroanatomik sistem izleme deneyleri için cerrahi ve mikroskopi görüntüleme prosedürleri daha önce tarif edilmiştir.28,32,59. Hedeflenen enjeksiyon merkezlerinin stereotaksik koordinatları ARA aracılığıyla belirlendi11 ve gerektiğinde ampirik olarak düzeltilir. Deney gününde farelere derin anestezi uygulandı ve izofluran gazı anestezisi (Datex-Ohmeda buharlaştırıcı) altında tutuldukları bir Kopf stereotaksik aparatına yerleştirildi. Ameliyattan önce farelere bir deri altı Ketoprofen enjeksiyonu (kg başına 4 mg) verildi ve gözlerine koruyucu bir oftalmik merhem uygulandı. Tek anterograd izleyici enjeksiyon deneyleri (PHAL veya AAV) için izleyiciler, 10 dakika boyunca alternatif 7 saniye açık – 7 saniye kapalı darbeli pozitif elektrik akımı (Stoelting, akım kaynağı) kullanılarak cam mikropipetler (iç uç çapı, 24–32 μm) aracılığıyla iyontoforetik olarak iletildi ve AAV’ler aynı yöntemle 2 dakika boyunca (iç uç çapı, 8–12 μm) iletildi. Anterograd/retrograd ortak enjeksiyon deneyleri (PHAL/CTB-647 ve AAV/FG) için, 10 dakika (PHAL/CTB-647) veya 5 dakika (AAV/FG) boyunca cam mikropipetler (iç uç çapı, 28-32 μm) aracılığıyla izleyici kokteyli iyontoforetik enjeksiyonlar yapıldı.
Çoklu retrograd izleme deneyleri için, her enjeksiyon bölgesinde, 50 nl retrograd izleyici, cam mikropipetler aracılığıyla 10 nl dk-1 oranında tek tek basınçla enjekte edildi.−1 (Drummond Nanoject III). Tüm enjeksiyonlar sağ yarıküreye yerleştirildi. Enjeksiyonların ardından kesikler dikildi ve fareler iyileşmek üzere evlerindeki kafeslerine geri gönderildi.
DP’deki projeksiyon tanımlı nöron popülasyonlarına (örneğin ACA’ya projekte olan DP nöronları) monosinaptik girdileri ortaya çıkarmak için değiştirilmiş bir TRIO (girdi ve çıktı arasındaki ilişkinin izlenmesi) stratejisini kullandık60. Kısaca, AAVretro-Cre, DP’nin (örneğin, ACA) aşağı akış projeksiyon hedefine enjekte edildi ve Cre’ye bağımlı TVA ve RG ifade eden yardımcı virüs (AAV8-hSyn-FLEX-TVA-P2A-GFP-2A-oG) ve mCherry ifade eden G-silinmiş kuduz virüsü (I. Wickersham laboratuvarı tarafından üretildi), DP projeksiyon nöron popülasyonunu etiketlemek için DP’ye enjekte edildi. (birinci derece) ve beyin çapındaki monosinaptik girdiler (ikinci derece). Aynı strateji, RE’deki DP projeksiyon nöronlarına monosinaptik girdiler üreten beyin yapılarının izini sürmek için de uygulandı.
PVH’de DPd’den CRH eksprese eden nöroendokrin nöronlara kadar monosinaptik girdileri tanımlamak için değiştirilmiş bir kuduz izleme stratejisi kullandık. CRH-Cre transgenik farelerinde, TVA ve kuduz glikoproteininin (RG) ekspresyonunu yönlendirmek için PVH’ye Cre’ye bağımlı bir yardımcı virüs (AAV8-hSyn-FLEX-TVA-P2A-GFP-2A-oG) enjekte edildi ve ardından mCherry eksprese eden enjeksiyon yapıldı. G– silinmiş kuduz virüsü (RbV-ΔG-mCherry). Bu yaklaşım, CRH nöronlarına doğrudan monosinaptik girdi sağlayan nöronları seçici olarak etiketler. Tüm viral vektörler MIT’deki Wickersham laboratuvarı tarafından üretildi.
Bu teknik, AAV1’in bir nöron popülasyonuna yeterince yüksek konsantrasyonda enjekte edilmesi durumunda viral parçacıkların aksonlar boyunca ilerleyeceği ve postsinaptik nöronları enfekte edebilecekleri sinaptik terminallerden salınacağı gerçeğinden yararlanır. Ayrıntılı metodoloji daha önce anlatılmıştı61. Kısaca, anestezi altındaki farelere hedef yapılara (örneğin, LHA) Cre’ye bağımlı AAV-FLEX-RFP veya GFP iyontoforetik olarak enjekte edildi ve yukarı akışlı bir yapıya (örneğin, DP) AAV1-Cre ile basınç enjekte edildi (20-80 nl). AAV1-Cre, aksonlar boyunca anterograd olarak aşağı doğru taşınır ve terminallerden salınır; burada yüksek konsantrasyonlarda Cre’ye bağımlı AAV-FLEX-RFP ile enfekte olmuş postsinaptik hücreleri transfekte eder. Yetersiz Cre ifadesi, aşağı akış nöronlarındaki güçlü florofor ifadesinin kilidini açmak için yeterlidir, dolayısıyla aksonal projeksiyonlarını ve terminallerini ortaya çıkarır. Ameliyat sonrası 3 haftalık iyileşmenin ardından farelere pentobarbital ile anestezi uygulandı ve perfüze edildi. Cre enjeksiyon bölgesi, fare anti-Cre rekombinaz monoklonal primer antikoru ile boyanarak doğrulandı (ayrıntılar için ‘Doku hazırlama ve immünohistokimya’ bölümüne bakın). AAV1-Cre kullanımıyla ilgili bir uyarı, virüsün geriye dönük olarak da hareket edebilmesi ve bağlantının öncelikli olarak tek yönlü olduğunun bilindiği durumlarda kullanılması gerektiğidir. Mevcut makalede AAV1-Cre’nin kullanıldığı tüm deneylerde, bağlantıların ağırlıklı olarak tek yönlü olduğu gösterilmiştir (BLA/SUBv/AUDv’den DP’ye ve DP’den CEA/LHA/PAG’ye; Ek Şekil 1). 11). Örnek olarak, DP projesinden omuriliğe (DP’den LHA’ya omuriliğe) girdi alan LHA nöronlarının olduğunu göstermek için DP’ye AAV1-Cre ve LHA’ya Cre’ye bağımlı bir AAV enjekte ettik. Eğer LHA DP’ye geri yansıyorsa, muhtemelen DP’ye yansıyan LHA nöronlarının aynı zamanda omuriliğe de yansıdığını gösteriyor olurduk. Ancak DP’den LHA’ya bağlantının tek yönlü olduğunu biliyoruz (Ek Şekil 1). 11b), bu da DP’den LHA’ya ve omuriliğe kadar olan sonuçumuza makul bir güven veriyor.
Enjeksiyon yeri konumlarının nasıl doğru bir şekilde belirlendiğine ilişkin ayrıntılar, bu kılavuzun ‘Enjeksiyon Yeri Analizi’ bölümünde verilmektedir. Ek Bilgiler.
Bildirilen bağlantılar aşağıdaki yöntemlerden en az biri aracılığıyla doğrulandı. Etiketlerin tutarlılığını değerlendirmek için farklı bölgeleri hedef alan enjeksiyonlar tekrarlandı. Cre’ye bağımlı anterograd ve TVA reseptörü aracılı kuduz takibi de bağlantıları doğruladı. Ayrıca, anterograd bağlantıları doğrulamak için anterograd terminal etiketlemesi sergileyen bölgelere retrograd izleyiciler uygulanırken, retrograd enjeksiyon verilerini doğrulamak için retrograd olarak etiketlenmiş projeksiyon hücrelerinin bölgelerine anterograd izleyiciler uygulandı. Bazı durumlarda, kanalrodopsin destekli devre haritalaması da bağlantıları doğruladı.
Hayvanlara, ameliyatlardan 7 gün sonra (kimyasal izleyiciler) veya 14 gün (viral izleyiciler) aşırı dozda sodyum pentobarbital (kg başına 6 mg) enjeksiyonu ile ötenazi uygulandı. Her bir hayvana transkardiyal olarak yaklaşık 50 ml %0.9 NaCl ve ardından 50 ml %4 paraformaldehit çözeltisi (PFA; pH 9.5) ile perfüze edildi. Beyinler 4 °C’de 24-48 saat boyunca %4 PFA’da sonradan sabitlendi, ardından kesitlere ayrılmadan önce %3 tip IB agaroza (Sigma-Aldrich) gömüldü. Dört seri koronal kesit bir Compresstome (VF-700, Precisionary Instruments) kullanılarak 50 µm kalınlığında dilimlendi ve işlem için hazırlandı. Dört bölümlü serilerden biri görüntüleme için immün boyamaya tabi tutuldu. Allen Referans Atlası’nın koronal seviyesi 53’ü içeren seri, deneyler arasında benzer kesit seviyesi dağılımlarını korumak için seçildi.
Çalışmalarda aşağıdaki birincil antikorlar kullanıldı: tavşan anti-PHAL (1:1.000; Vector Laboratories, AS-2300), tavşan anti-fluorogold antikoru (1:5.000; Millipore-Sigma, AB153-I), fare anti-Cre rekombinazı (1:4.000; Mercd Millipore, MAB3120), sıçan monoklonal FOS antikoru (1:1.000; Synaptic) Systems, 226017), fare anti-oksitosin antikoru (4G11, 1:5,000; Millipore-Sigma, MAB5296), tavşan anti-vazopressin antikoru (1:5,000, Millipore-Sigma, AB1565), tavşan-anti somatostatin antikoru (1:500, Millipore-Sigma, SAB4502861) ve streptavidin biyositin etiketli kayıtlı nöronlar (1:1.000; Thermo Fisher Scientific, S21374).
Kısaca kesitler, normal eşek serumu (Vector Laboratories) ve Triton X-100 (VWR) içeren bloklama solüsyonuna 1 saat süreyle aktarıldı. Üç adet 5 dakikalık durulamadan sonra bölümler, eşek serumu, Triton X-100 ve uygun seyreltmede bir birincil antikor içeren bir KPBS çözeltisi içinde (her bir birincil antikorun konsantrasyonu yukarıda açıklanmıştır) 4 °C’de 48-72 saat süreyle inkübe edildi (Vector Laboratories, AS-2300). Kesitler KPBS’de üç kez durulandı ve daha sonra eşek serumu, Triton X-100 ve uygun seyreltmede karşılık gelen ikincil antikor çözeltisini içeren ikincil antikor çözeltisine 3 saat süreyle batırıldı (Alexa Fluor 488, 555 veya 647 ile konjuge edilmiş anti-tavşan IgG için 1:500; Invitrogen, A-21206 (488), A-31573 (647); Alexa Fluor 488 veya 647 ile konjuge edilmiş anti-fare IgG: Life Technology: A-21202 (488) ve A-31571 (647); Alexa Fluor 647 ile konjuge edilmiş anti-fare IgG: Jackson ImmunoResearch, 715-605-150. Kesitler tekrar üç kez KPBS ile yıkandı. Seçilen tüm kesit serileri, bir floresan Nissl lekesi, NeuroTrace 435/455 (NT, 1:500, Invitrogen, N21479) ile zıt boyandı. Kesitler daha sonra monte edildi ve %65 gliserol kullanılarak lamellendi.
Derin anestezi uygulanan hayvanlara perfüze edildi ve beyinler, gece boyunca %4 PFA’da sonradan sabitlendi, ardından kriyokoruma için sırasıyla %15 ve %30 sakaroz içine daldırıldı. Daha sonra beyinler bölümlere ayrıldı (20 µm) ve RNAscope Multiplex Fluorescent v2 tahlili, Advanced Cell Diagnostics tarafından sağlanan kılavuza göre gerçekleştirildi. Kısaca, doku kesitlerini içeren slaytlar önceden soğutulmuş %4 PFA’da 15 dakika boyunca 4 °C’de sonradan sabitlendi ve daha sonra oda sıcaklığında 5 dakika boyunca bir dizi %50, %70 ve %100 etanol solüsyonunda dehidre edildi. Her kesite oda sıcaklığında 10 dakika boyunca hidrojen peroksit uygulandı ve daha sonra 99 °C’de 5 dakika boyunca hedefe erişim gerçekleştirildi. Daha sonra numunelere Proteaz III ilave edildi ve HybEZ fırınında 40 °C’de 30 dakika inkübe edildi. Sonraki RNAscope tahlili, birden fazla hibridizasyon adımı (prob ve AMP bağlanması) ve sinyal geliştirme (HRP kanalı bağlanması) ile oluşturuldu; her biri, üreticinin protokolünde (Multiplex floresan v2 kiti) açıklandığı gibi slaytların 1x yıkama tamponunda yıkanması izledi. Opal floroforlar (Akoya Biosciences), RNA sinyallerini görselleştirmek için 1:1.500 oranında seyreltildi. RNAscope testinden sonra kesitler DAPI (1:500, Thermo Fisher Scientific, D1306) ile zıt boyandı ve monte edildi. Görüntüler Dragonfly Yüksek Hızlı Eş Odaklı Mikroskop Sistemi (Andor) kullanılarak elde edildi. Bu çalışmada aşağıdaki problar kullanılmıştır: Cux2 , Etv1 , Arkaplan4SS, CRH ve TRH.
50 µm’lik bölümlerin tümü, Olympus VS120 yüksek verimli mikroskop kullanılarak yüksek çözünürlüklü sanal slayt görüntüsü (VSI) dosyaları olarak tarandı. Görüntü kaydı, izleyici segmentasyonu ve niceleme dahil olmak üzere edinme sonrası işleme yöntemleri aşağıda ayrıntılı olarak açıklanmaktadır. Kısaca, enjeksiyon bölgesinin ve buna karşılık gelen aynı taraftaki etiketlemenin doğru sağ yarıkürede olduğundan emin olmak için tüm görüntüler ters çevrildi. Bu, mikroskoba eşlik eden VS-Desktop yazılımı kullanılarak gerçekleştirildi. Görüntüler daha sonra görüntü işlemeye yönelik özel yazılımımız olan Outspector’a aktarıldı (bkz. ‘Outspector: tescilli 2D görüntü işleme hattımız’ bölümü). Tamamlayıcı Yöntemler) ve yüksek performanslı bir bilgi işlem kümesinde işlenir. İlk geçişte tam otomatik kayıt gerçekleştirildi ve ardından sonuçları incelendi ve gerektiğinde ince ayar yapıldı. Kayıtlı görüntüler üzerinde varsayılan parametrelerle izleyici segmentasyonu gerçekleştirildi. Segmentasyon sonuçları da incelendi ve gerekirse etkileşimli parametre ayarlamaları yapıldı. Tüm bölüm seviyelerinde her beyin bölgesinde segmentlere ayrılmış piksel sayıları ve hücre sayıları oluşturuldu ve analiz için kullanıldı.
Outspector, etiketli yolları yüksek verimli bir şekilde güvenilir bir şekilde çarpıtmak, yeniden yapılandırmak, açıklama eklemek ve analiz etmek için özel olarak tasarlanmış bilişim iş akışımızdır. Analiz edilen her vakanın doku bölümleri karşılık gelen ARA seviyelerinin standart şablonlarına atandı ve kaydedildi. Bu Makalede gösterilen tüm görseller çarpıtılmamış, kayıtsız VSI görsellerinin ham verilerinden alınmıştır. Eşik parametreleri her vaka ve izleyici için ayrı ayrı ayarlandı. Eşik çıktı dosyalarındaki göze çarpan kusurları düzeltmek için Adobe Photoshop kullanıldı. Etiketleme görünürlüğünü en üst düzeye çıkarmak için her renk kanalının parlaklık/kontrast ayarı yapıldı (Nissl Neurotrace 435/455 parlak alana dönüştürülür) ve TIFF görüntüleri daha sonra JPEG dosya formatına dönüştürülür. Tüm Outspector işleme adımları ve analizleri için kullanılan ayrıntılı hesaplamalar, bu belgenin ‘Outspector: tescilli 2D görüntü işleme hattımız’ bölümünde verilmektedir. Tamamlayıcı Yöntemler.
Imaris’te noktalar işlevi kullanılarak eşikler, her kanal için en fazla pozitif hücreyi seçecek şekilde ayarlandı (405, 488, 561 ve 642). Otomatik algılamanın ardından manuel kalite kontrolü gerekliydi. 405’teki DAPI ile RNA puncta arasındaki uzaysal ilişki Fezf2 Yanlış negatifleri düzeltmek ve yanlış pozitif noktaları otomatik algılamadan çıkarmak için görsel bir yardım olarak kullanıldı. Doğruluğu sağlamak için her kanal birden çok kez kalite kontrolünden geçirildi.
DP nöronlarının ince ayrıntılı morfolojisini açıklamak için MORF3 farelerine AAV-retro Cre veya AAV1-Cre enjekte ettik. Daha sonra enjeksiyonlardan 3-4 hafta sonra farelere perfüze edildi. V5 antikoru ile immün boyama, bu MORF3 nöronlarının ince ayrıntılı nöronal morfolojisinin görselleştirilmesine olanak tanır. Bu yaklaşım, DP kortikal projeksiyon nöronlarının hücre tipine özgü morfolojik özelliklerini görüntülememizi, yeniden yapılandırmamızı ve analiz etmemizi sağladı. Aynı stratejiyi izleyerek LHA’da ince detaylı dendritik morfolojiye sahip seyrek etiketli nöronları da ortaya çıkardık.
3D doku işleme için SHIELD temizleme protokolü kullanıldı62. Farelere transkardiyal olarak soğuk salin ve SHIELD perfüzyon çözeltisi ile perfüze edildi. Beyinler parçalara ayrıldı, SHIELD bazlı bir beyin temizleme yöntemine tabi tutuldu ve eFLASH kullanılarak V5 için immün boyama yapıldı (Alexa Fluor 647 ile konjuge ikincil antikorla MORF3’ü ortaya çıkarmak için)25,62,63. Beyinler SmartClear ve SmartLabel makineleri (LifeCavas SmartBatch) kullanılarak işlendi. Tüm beyinler, Life Canvas SmartSPIM ışık sayfası mikroskobu kullanılarak x15’te (0,42 μm × 0,42μm × 0,42 μm) görüntülendi. Syp-eGFP aksonal terminallerini, tdTomato-pozitif kortikal nöronları ve bunların aksonlarını ve MORF3-pozitif postsinaptik nöronları görüntülemek için sırasıyla üç lazer (488, 555, 647 nm) kullanıldı.
Kalın kesitlerde görüntü elde etmek için tüm beyin 500 µm’lik kesitlere kesildi ve 37 °C’de 72 saat boyunca SDS tamponunda temizlendi. Kesitler daha sonra üç kez KPBS ile yıkandı ve KPBS içerisinde 4 °C’de 24 saat inkübe edildi. Kesitler monte edildi ve indeks eşleştirme çözümüyle (%100, EasyIndex, LifeCanvas Technologies, EI-Z1001) 25 x 75 x 1 mm cam slaytlara kapatıldı. Kesitler, yüksek hızlı dönen diskli eş odaklı bir mikroskop (Andor Dragonfly 202 Imaging System, Andor, Oxford Instruments Company, CR-DFLY-202-2540) ile görüntülendi. Genel bir bakış elde etmek için ×10 büyütme (NA 0,40, Olympus, UPLXAPO10X) kullanıldı, ardından 1 µm’de ×30 büyütme (Olympus, UPLSAPO30xSIR, NA 1,05, WD: 0,80 mm) kullanıldı zince ayrıntılı dendritik morfoloji ve varsayılan sinaptik bağlantılar için yüksek çözünürlüklü görüntüler elde etmek amacıyla adımlar veya x60 büyütme (Olympus, UPLASAPO60XS2, NA 1,30, WD: 0,30 mm) kullanıldı. Bölümler dört uyarma dalga boyuyla görüntülendi: 405 nm (mavi Nissl arka planı), 488 nm (AAV-GFP için) ve 647 nm (MORF3 için uzak kırmızı), ilgili emisyon algılama dalga boyları 450 nm, 525 nm ve 600 nm ile.
Vaa3D kullanılarak nöronların manuel olarak yeniden yapılandırılması gerçekleştirildi64,65 veya Hızlı Nörit İzleyici66ardından dendritik çardakların morfolojik onarımı, sınıflandırılması ve tiplendirilmesi takip eder. Yeniden yapılanmalar Imaris ve neuTube’a yüklenerek tamamlandı67 ve yaygın olarak kullanılan swc dosya formatında sonlandırıldı68. Toplamda 47 yeniden yapılandırılmış DP nöronu, Trees Toolbox ortamındaki işlevlerden yararlanılarak MATLAB’da morfolojik olarak analiz edildi.69. 47 DP nöronu, dört MORF3 faresinden toplandı. Spesifik olarak, analiz komut dosyaları, toplam dendritik kablolama uzunluğu, dal sayısı, ortalama dal açısı, ortalama kök açısı, dal asimetrisi, ortalama dal sırası, ortalama Strahler sırası ve orta hattan mesafe dahil olmak üzere bir dizi parametre boyunca tüm nöronları ölçtü. Daha sonra parametreler arasındaki varyans katsayıları ölçüldü ve ardından kullanılarak sınıflandırma yapıldı. k -kümelenme anlamına gelir. Toplam dendritik uzunluk ve toplam dal sayısıyla tanımlanan dendritik çardakların boyutu ve karmaşıklığı, en çeşitli olanı olarak ortaya çıktı. Daha sonra tüm nöronları ilk olarak dendritik çardak boyutu ve karmaşıklığına göre sınıflandırdık, ardından tüm hücre gövdelerinin orta hattan uzaklığına dayalı olarak yüzeysel ve derin katman sınıflandırmasını izledik. Her iki sınıflandırmanın her biri iki nöron kümesi oluşturdu. Yüzeysel ve derin katmandaki nöronlar daha sonra boyut, karmaşıklık ve dendritik yönelim açısından karşılaştırıldı. Benzer şekilde iki morfolojik küme (küçük-basit ve büyük-karmaşık) orta hattan uzaklıkları açısından karşılaştırıldı.
Bu karşılaştırmalar tek kuyruklu parametrik olmayan Wilcoxon işaretli sıralama testleri kullanılarak yapıldı. Ptestlerden elde edilen değerler, çoklu karşılaştırmaları hesaba katmak için FDR düzeltmesi kullanılarak düzeltildi.
Yabani tip farelerde, AAV1-Cre (anterograd trans-sinaptik Cre) AUDv’ye enjekte edilirken, AAV-hSyn-ChR2-YFP (UPenn Vector Core) ENTI’ye (UPenn Vector Core) enjekte edildi.N= 5; İncir. 5a) veya PIR (N = 6 Şekil. 5c) farklı hayvanlardan. Ayrı deneylerde, AAV-hSyn-ChR2-YFP, CRH-Cre Ai14 farelerinin DP’sine enjekte edildi (N = 7; İncir. 4g). Örnek boyutları önceki deneyimlere göre seçilmiştir. Fareler farklı gruplara atanmadığından randomizasyon ve körleme yapılmadı.
Kanalrodopsin ve izleyici enjeksiyonlarından iki hafta sonra elektrofizyolojik kayıtlar için akut beyin dilimleri hazırlandı. İzofluran ile anestezinin ardından farenin kafası kesildi ve beyin hızla çıkarıldı ve buz soğukluğunda yüksek sakaroz dilim çözeltisine daldırıldı: 208 mM sakaroz, 2,5 mM KCl, 1,25 mM NaH2PO426 mM NaHCO31,3 mM MgCl28 mM MgS044 ve 10 mM glukoz; %95 O ile doyurulmuş2 ve %5 CO2; PH’ı 7.4. Titreşimli bir mikrotom (Leica, VT1000S) kullanılarak koronal düzlemde beyin dilimleri (kalınlık, 350 mikron) kesildi. Dilimlerin, 130 mM NaCl, 3 mM KCl, 1,25 mM NaH içeren ısıtılmış (32-34 °C) ACSF ile doldurulmuş bir daldırma odasında en az 30 dakika boyunca iyileşmesine izin verildi.2PO426 mM NaHCO32 mM CaCl222 mM MgCl2 ve %95 O ile oksijenlenmiş 10 mM glikoz2 ve %5 CO2pH 7,2–7,4, 290–310 mOsm ve ardından kayıt yapılıncaya kadar kademeli olarak oda sıcaklığına kadar soğutuldu. RFP ve ChR2 (YFP) etiketlemesinin varlığı, kayıttan önce dilimlerde sırasıyla yeşil ve mavi floresan uyarımı ile belirlendi. Tam hücreli yama kelepçe kayıtları için yaklaşık 3-4 MΩ empedansa sahip yama pipetleri kullanıldı. Cam pipetler, aşağıdaki tuz konsantrasyonlarına sahip bir Cs-metansülfonat bazlı dahili çözelti içeriyordu: 130 mM Cs-metansülfonat, 10 mM CsCl, 4 mM NaCl, 1 mM MgCl25 mM mM 150 mM MgATP, 5 mM EGTA, 10 mM HEPES, 5 mM GTP, 10 mM fosfokreatin ve 0,1 mM löpeptin (151 CsOH ile pH 7,2, 270 mOsm) ve biyosit (%0,2). Mavi ışık stimülasyonuna monosinaptik yanıtların izolasyonu ve kaydedilmesi için tetrodotoksin (Na+ kanal engelleyici, 1 μM) ve 4-aminopiridin (K+ Harici çözüme kanal engelleyici, 100 μM) eklendi. Uyarıcı akımlar için -70 mV tutma voltajında voltaj kelepçe modunda pClamp yazılımını (v.10.5) çalıştıran bir MultiClamp 700B amplifikatörü (Moleküler Cihazlar) ile kırmızı etiketli nöronlardan sinyaller kaydedildi, 1 kHz’de filtrelendi ve 10 kHz’de örneklendi. Mavi ışık (470 nm) uyarımı, bir LED (CoolLED) aracılığıyla 5 deneme için ~1 mW güçte 0,5 ms’lik bir darbe kullanılarak iletildi. Sinyaller Clampfit (v.10.5) kullanılarak analiz edildi. Yanıt veren nöronlar için, denemeler arasında en yüksek yanıtların ortalaması alındı (teknik kopya). Daha sonra her hücrenin ortalama değeri, ortalama, medyan, sd ve benzerlerini (biyolojik kopya) hesaplamak için her deney için diğer hücrelerle birleştirildi. Işıkla uyarılmış sinaptik tepkilerin gerçekten uyarıcı olduğunu göstermek için, AMPA reseptörleri için seçici glutamat reseptör antagonistleri CNQX (20 uM) ve NMDA reseptörleri için APV (50 uM) banyo çözeltisine eklendi.
Kayıttan sonra dilimler PFA ile sabitlendi ve ardından kaydedilen nöronların konumunu ortaya çıkarmak ve doğrulamak amacıyla biyositin boyama için PBS’ye aktarıldı. Biocytin boyama aynı zamanda kaydedilen DP veya PVH nöronlarının morfolojisini de ortaya çıkardı (ayrıntılar için ‘Doku hazırlama ve immünohistokimya’ bölümüne bakın).
AUDv’nin optogenetik uyarılmasıyla uyarılan akımların ortalama tepe genliğini, ENTl veya PIR girişi alan DP nöronlarıyla karşılaştırmak için parametrik olmayan Mann-Whitney sen-testler kullanıldı ve Pdeğer ayarlamaları gerekli değildi.
Toplam 15 fare (erkek C57BL/6, 2 aylık) deney veya kontrol grubuna rastgele atandı. Deneylerin her biri için örnek boyutları önceki deneyimlerimize göre seçildi ve sonuçlara göre önemli farklılıkları tespit etmek için yeterli güce ulaşıldı. Hayvanların her birine, SUBv ve BLAa’ya iki taraflı AAV1-Cre enjeksiyonu yapıldı; bu, Cre’nin DP nöronlarına anterograd olarak taşınmasına ve trans-sinaptik olarak etiketlenmesine olanak sağladı. Hayvanlara ayrıca DP’ye iki taraflı Cre bağımlı AAV-FLEX-ChR2 (30 nl) enjeksiyonu yapıldı. Sonuç olarak, yalnızca SUBv ve BLAa’ya sinaptik sonrası DP nöronları ChR2’yi eksprese eder ve PVH dahil olmak üzere hipotalamik nöroendokrin bölgeye projeksiyonlar üretir. Optik fiberler (200 μm çekirdek çapı, 0,37 sayısal açıklık; Inper), bregma kafatası yüzeyinin ventralinde -1,6 mm derinlikte enjeksiyon bölgesinin üzerine implante edildi ve süper yapıştırıcı ve diş çimentosu kullanılarak kafatasına sabitlendi.
Optogenetik stimülasyon ameliyattan 7-8 hafta sonra gerçekleştirildi. Testten önce fareler, günde 30 dakika boyunca art arda 4 gün boyunca test kafesine (yeni fare kafesi) ve optik fiberlere ayrı ayrı alıştırıldı. Test gününde fareler, 2 saat boyunca yalnızca test kafesine alıştırıldı ve optogenetik uyarımdan önce 15 dakika boyunca optik fiberlere bağlandı. 15 ms’lik darbelerle 20 Hz’de darbe yapan 473 nm’lik bir lazer, toplam 20 dakika boyunca 30 saniyelik açık ve 30 saniyelik kapalı döngüler boyunca uygulandı. Işık ışınımı 4–5 mW mm civarındaydı−2 hedef bölgede. Lazer stimülasyonundan sonra optik fiberler çıkarıldı ve fareler, ötenaziden önce 25 dakika boyunca test kafesinde rahatsız edilmeden kaldı. CORT seviyeleri üzerindeki sirkadiyen ritim etkilerini en aza indirmek için hayvanlar, karanlık aşamada ışıklar kapatıldıktan 1,5 ila 5 saat sonra test edildi; kontrol ve ChR2 grupları test sırasında dengelendi.
Hızlı servikal dislokasyondan sonra terminal gövde kanı heparinize mikrokapiller tüplerle (Thermo Fisher Scientific) toplandı ve mikrofüj tüplere aktarıldı ve bunlar en az 15-20 dakika buz üzerinde bırakıldı. Kan örnekleri 4 °C’de 15 dakika boyunca 2.500 rpm’de santrifüjlendi. Süpernatan (serum) toplanıp yeni tüplere aktarıldı ve serum örnekleri -80 °C’de donduruldu. Numuneler paketlendi ve kuru buz üzerinde Virginia Üniversitesi Tıp Fakültesi Üreme Ligand Testi ve Analiz Çekirdeği Araştırma Merkezi’ne gönderildi; burada CORT ölçümleri için bir radyoimmünoanaliz kiti kullanılarak (iki kopya halinde) işlendiler. Beyinler 50 mikron kalınlığında kesitlere ayrıldı ve implante edilen optik fiberlerin konumunu değerlendirmek için Nissl boyandı. Bilateral implant konumunun doğruluğunu değerlendiren araştırmacı, hayvanın tedavi durumu konusunda kördü. Analize yalnızca DP’de doğru çift taraflı implantlara sahip hayvanlar dahil edildi.
Deney ve kontrol grupları arasındaki CORT düzeylerini karşılaştırmak için Öğrencinin T-test ve parametrik olmayan Mann–Whitney sen-testler kullanıldı. İki grup karşılaştırması nedeniyle, Pdeğer ayarlaması gerekli değildi.
Altı VGLUT2-Cre (DP için) ve altı VGLUT1-Cre (ILA için) erkek fareye (6-8 haftalık), %1-2 izofluran-oksijen karışımı kullanılarak anestezi uygulandı ve tek taraflı olarak 350 nl (1 nl·s) enjekte edildi.−1) pAAV.Syn.Flex.GCaMP6f.WPRE.SV40’ı (Addgene, 100833-AAV1) DP’ye yerleştirin. Daha sonra, virüs enjeksiyonundan 30 dakika sonra DP’nin üzerine 6,1 mm uzunluğunda (0,5 mm çap) bir röle lensi (Inscopix) implante edildi: ön-arka, +2,1 mm, mediolateral, 0,6 mm; dorsoventral, -3,2 mm. Lens, siyanoakrilat yapıştırıcı ve diş çimentosu kullanılarak kafatasına güvenli bir şekilde sabitlendi ve ardından Kwik-Sil (WPI) ile kaplandı. Deneylerin her biri için numune boyutları önceki deneyimlere dayanarak seçildi. VGLUT2-Cre hayvanları DP’ye enjeksiyon aldığından ve VGLUT1-Cre fareleri ILA’ya enjeksiyon aldığından rastgeleleştirme gerekli değildi. Ayrıca hayvanların her birine hem sosyal hem de sosyal olmayan etkileşim davranış testleri uygulandı (aşağıya bakınız).
Üç hafta sonra, farelere daha önce anlatıldığı gibi anestezi uygulandı ve GCaMP6f ifadesini görselleştirmek için taban plakası takılı bir UCLA V4 miniskobu lensin üzerine yerleştirildi. Odak düzlemi hücre görünürlüğünü optimize edecek şekilde ayarlandı ve taban plakası diş çimentosu ile yerine sabitlendi. Lensi taban plakasının üzerine kapatmak ve korumak için plastik bir kapak kullanıldı.
DP veya ILA’ya lens implantasyonu yapılan fareler, 4-5 gün boyunca kullanım ve miniskopa alıştırıldı. Açık alan testinin yapıldığı gün miniskop taban plakasına takıldı ve fareler açık bir alanda (45 cm x 45 cm x 30 cm) 20 dakika boyunca serbestçe koştu. Eşcinsel sosyal etkileşim gününde fareler, açık alan testiyle aynı alanda, oturum başına 8 dakika boyunca nesne keşfiyle dengelenen sosyal etkileşim gerçekleştirdi. Ertesi gün, fareler 8 dakika boyunca karşı cinsiyetteki sosyal hedeflerle sosyal etkileşim gerçekleştirdi. Her sosyal deneme, söz konusu farenin tek başına 1 dakikalık bir periyoduyla başlayan ve ardından sosyal partnerle 7 dakikalık bir etkileşimle başlayan 8 dakikalık bir kayıt oturumunu içeriyordu. Eşcinsel sosyal etkileşimin nesne keşfiyle dengelendiği günde, ilk denemeden sonra denek fare, ikinci denemeye başlamadan önce yaklaşık 5 dakika boyunca LED kapalıyken dinlendi. Kalsiyum görüntüleme ve davranışı (miniCam) aynı anda 30 Hz’de kaydedildi.
Kalsiyum görüntüleme videoları hareketle düzeltildi (NoRMCorre: https://github.com/flatironinstitute/NoRMCorre; MiniAn: https://github.com/denisecailab/minian) ve genişletilmiş kısıtlı negatif olmayan matris çarpanlarına ayırma (CNMF-E)-algoritma tabanlı paketlerle analiz edildi (MiniscopeAnaliz: https://github.com/etterguillaume/MiniscopeAnaliz; MiniAn: https://github.com/denisecailab/minian) hücreleri tanımlamak ve hücre aktivitesini çıkarmak için. Daha ileri analizler için gürültüsü giderilmiş ve karıştırılmamış iz verileri kullanıldı.
Bireysel bir nöronun aktivitesinin sosyal etkileşim tarafından önemli ölçüde modüle edilip edilmediğini belirlemek için, ikili hale getirilmiş manuel olarak puanlanan etkileşim nöbetlerine gürültüden arındırılmış kalsiyum izi yazışması için eğri altındaki alan (AUC) değerini hesaplamak üzere ROC analizini kullandık. Etkileşim nöbetleri, görüntülenen fare, sosyal hedefi/nesneyi, fare vücut uzunluğunun dörtte biri ila üçte biri kadar bir mesafe içinde aktif olarak araştırdığında tanımlandı. AUC değerlerinin, nöronun etkileşim nedeniyle önemli ölçüde uyarıldığını veya inhibe edildiğini gösterip göstermediğini belirlemek için, gözlemlenen AUC değerlerini, dairesel olarak karıştırılan kalsiyum sinyallerinden (1000 karıştırma) türetilen boş bir dağılımla karşılaştırdık. Anlamlılık, yüzdelik eşikler kullanılarak belirlendi; auROC değerleri, uyarılmış nöronlar için 97,5’inci yüzdeliği veya inhibe edilmiş nöronlar için 2,5’inci yüzdeliği aşarsa, nöronlar önemli ölçüde duyarlı olarak sınıflandırıldı. Heyecanlanmayan veya engellenmeyen nöronların tepkisiz olduğu kabul edildi.
Kalsiyum geçici olayları, MATLAB’daki (peakfinder) otomatik algılama algoritmaları kullanılarak tanımlandı (https://github.com/GradinaruLab/striatum2P).
DP-miniskoplu veya ILA-miniskoplu hayvanlarda, sosyal olmayan (nesne) ve sosyal (aynı veya karşı cinsten partner) testler sırasında etkileşimde bulunmak için harcanan sürede farklılıklar olup olmadığını incelemek için, çok amaçlı tek yönlü bir ANOVA yapıldı ve ardından aile bazında hata oranını kontrol eden post hoc Tukey’in çoklu karşılaştırma testi yapıldı. Sosyal olmayan (açık alan) ve sosyal (aynı veya karşı cinsten partner) testler sırasında davranışsal olarak duyarlı hücrelerin yüzdesini ve kalsiyum olaylarının sıklığını değerlendirmek için, çok amaçlı iki yönlü bir ANOVA gerçekleştirildi ve ardından Tukey testleri (DP veya ILA karşılaştırmaları için) veya Šidák’ın düzeltilmiş testleriyle post hoc analizler yapıldı. PÇoklu karşılaştırmalar için değerler (DP ve ILA karşılaştırmaları için).
Çalışma için yaşları 12 ila 14 hafta arasında olan 24 erkek fare kullanıldı. Test ortamından kaynaklanan potansiyel stresi azaltmak için her fare, art arda dört gün boyunca temiz bir kafese alıştırıldı, kafeste 2 ila 4 saat geçirdi ve günlük olarak yaklaşık 30 dakika kayıt pozisyonunda kaldı. Test gününde fareler, deneyden yaklaşık 2 saat önce temiz kafese alıştırıldı. Tanıdık olmayan erkek fareler, dişi fareler ve doğum sonrası 7. gün yavruları sosyal uyaran olarak kullanıldı. Her fare, her grupta altı fare olmak üzere, toplam 20 dakika boyunca, her biri yaklaşık 6 dakika süren, aynı türde sosyal uyaranın üç örneğine maruz bırakıldı. Kontrol grubunda ise kafesler üç kez açıldı ancak herhangi bir davetsiz misafir içeri girmedi. Fareler perfüzyondan önce 80 dakika boyunca kendi kafeslerinde rahatsız edilmeden kaldı.
Hayvanlar (N= 4, erkek) akut kısıtlama stresine maruz kalan koloni odasından çıkarıldı, 1 saat boyunca bir davranış test odasına aktarıldı ve daha sonra fareler için bir Tailveiner sınırlayıcıya (Braintree Scientific) yerleştirildi. Bu cihaz, içinde istemli hareketi sınırlayacak şekilde ayarlanan bir tıkacın bulunduğu şeffaf bir tüpten oluşur. Akut kısıtlama stresi 30 dakika süreyle uygulandı ve hayvanlara ötenazi yapılmadan 30 dakika önce sonlandırıldı. Tüm çalışmalar boyunca kontrol fareleri (N= 4, erkek), kısıtlama stresi grubundaki farelere yönelik olanlara paralel olarak gerçekleştirilen çok sayıda duyusal manipülasyona tabi tutuldu.
TRAP2-CreER70 ve Ai14 fareleri Jackson Laboratuvarı’ndan elde edildi (www.jax.org/strain/030323; www.jax.org/strain/007908). Homozigot TRAP2-CreER ve Ai14 fareleri, TRAP2-CreER/Ai14 yavruları oluşturmak için yetiştirildi.
4-Hidroksitamoksifen (4-OHT; Sigma-Aldrich, H6278), 20 mg ml-1’de çözüldü−1 37 °C’de 15 dakika boyunca çalkalanarak etanol içerisinde, daha sonra 10 mg ml-1’lik bir nihai konsantrasyon elde etmek üzere mısır yağı ilave edildi.−1ve etanol santrifüjleme altında vakumla buharlaştırıldı. Tüm TRAP2-CreER deneylerine 4-OHT (intraperitoneal (ip), kg başına 50 mg) enjekte edildi70,71.
Dört TRAP-Cre faresi rastgele iki gruba ayrıldı: kontrol (N= 2) ve ayak şokuna dayalı korku koşullandırması (N= 2). İşitsel uyarım için (gürültü grubu), 1. ve 2. günde, TRAP2/Ai14 fareleri, günde 1 saat boyunca ses geçirmez bir odada özel yapım kutulara uyarlandı. 3. günde fareler, beyaz gürültüye maruz kalmadan önce 12 saat boyunca ses geçirmez bir odada kendi kafeslerine yerleştirildi. Fareler daha sonra özel yapım kutulara yerleştirildi ve 1 saat boyunca geniş bantlı beyaz gürültü uyarımına (70 dB SPL) maruz bırakıldı.
Ayak şoku grubunda, 1. günde fareler, 1 saat boyunca ses geçirmez bir odada özel yapım kutularda iklime alıştırıldı. 2. günde (şartlandırma), fareler metal ızgara zeminli özel yapım kutulara konuldu. Şartlandırma odasına 10 dakika alıştıktan sonra hayvanlar, beş kez 0,75 mA ayak şokuyla (her darbenin süresi = 100 ms ile 1 saniye için 5 Hz) birlikte sonlandırılan 20 saniyelik gürültüye (70 dB SPL) maruz bırakıldı.72. 3. günde fareler yalnızca 1 saat geniş bant beyaz gürültüye maruz bırakıldı. Daha sonra farelere 4-OHT enjeksiyonu (ip, kg başına 50 mg) verildi ve ev kafeslerine geri gönderildi. Kafes, 4-OHT enjeksiyonundan 12 saat sonra hayvan tesisimize geri taşındı. Ses uyarımı ve 4-OHT enjeksiyonu ses geçirmez bir odada gerçekleştirildi. 12. günde farelere ayrıca yaklaşan ses uyaranları sunuldu. Art arda on kreşendo ses uyaranından oluşan bir dizi (yoğunluğu 0,4 saniyede doğrusal olarak 20 dB SPL’den 70 dB SPL’ye arttı ve ardından 20 dB SPL’de yoğunlukla 0,6 saniyelik aralıklarla) tren uyaranları arasında 10 saniyelik aralıklarla 10 dakika boyunca tekrarlandı. Fare 1,5 saatlik dinlenmenin ardından ötenazi edildi.
Kontrol farelerine işitsel uyarı grubuyla aynı prosedürler uygulandı ancak herhangi bir ses uyarısı olmadan.
Bu yazıda kullanılan ARA faresine ait görüntüler çevrimiçi olarak mevcuttur (https://mouse.brain-map.org/)11. Daire haritalarının görselleri alıntı yapılan makaleden ücretsiz olarak indirilebilir73. ABA’dan alınan parlak alanlı yerinde hibridizasyon görüntüleri çevrimiçi olarak mevcuttur (https://mouse.brain-map.org/)74. Beynin arka plan 3 boyutlu görüntülerini oluşturmak için Ortak Koordinat Çerçevesi (CCF) kullanıldı ve çevrimiçi olarak mevcuttur (https://alleninstitute.github.io/abc_atlas_access/descriptions/Allen-CCF-2020.html)75.
Araştırma tasarımına ilişkin daha fazla bilgi şu adreste mevcuttur:Doğa Portföyü Raporlama Özeti bu makaleye bağlı.
 1
HEMOROİD – DR. DEVRİM DEMİREL VE DR. GAFFAR KARADOĞAN
1189 kez okundu
1
HEMOROİD – DR. DEVRİM DEMİREL VE DR. GAFFAR KARADOĞAN
1189 kez okundu
 2
Jurnal ve Jurnalcilik ne demek? Osmanlı’dan günümüze ihbarcılık
196 kez okundu
2
Jurnal ve Jurnalcilik ne demek? Osmanlı’dan günümüze ihbarcılık
196 kez okundu
 3
Hindistan’ı yöneten cesur Türk kadını: Raziye Sultan’ın tarihi hikayesi
177 kez okundu
3
Hindistan’ı yöneten cesur Türk kadını: Raziye Sultan’ın tarihi hikayesi
177 kez okundu
 4
Papa Francis’in son vasiyeti ortaya çıktı: Yeni Papa Leo’nun ilk rotası Türkiye mi olacak?
161 kez okundu
4
Papa Francis’in son vasiyeti ortaya çıktı: Yeni Papa Leo’nun ilk rotası Türkiye mi olacak?
161 kez okundu
 5
Avustralya ‘Çöp Papağanları’ artık yerel bir ‘içme geleneği’ geliştirdi
161 kez okundu
5
Avustralya ‘Çöp Papağanları’ artık yerel bir ‘içme geleneği’ geliştirdi
161 kez okundu